반응형

- 극성 반응: 분자 내의 작용기에 있는 양으로 편극된 중심과 음으로 편극된 중심 사이의 전기적인 인력 때문에 일어남.
- 대부분의 유기 분자들은 전기적으로 중성이나, 결합에 비대칭적인 전자 분포의 결과로 결합에 극성이 생기고, 결합 원자들의 서로 다른 전기음성도 때문에도 나타난다.
- 산 또는 염기를 가진 작용기의 상호작용으로부터 극성 결합이 생길 수도 있다.
- 산소, 질소, 플루오린, 염소는 탄소보다 더 전기음성적 → 이들과 결합한 탄소 원자는 부분적인 양전하를 가짐.
- 금속은 탄소보다 덜 전기음성적 → 금속에 결합된 탄소는 부분적인 음전하를 가짐.
- 표 6-1. 몇 가지 일반적인 작용기에서 극성 경향
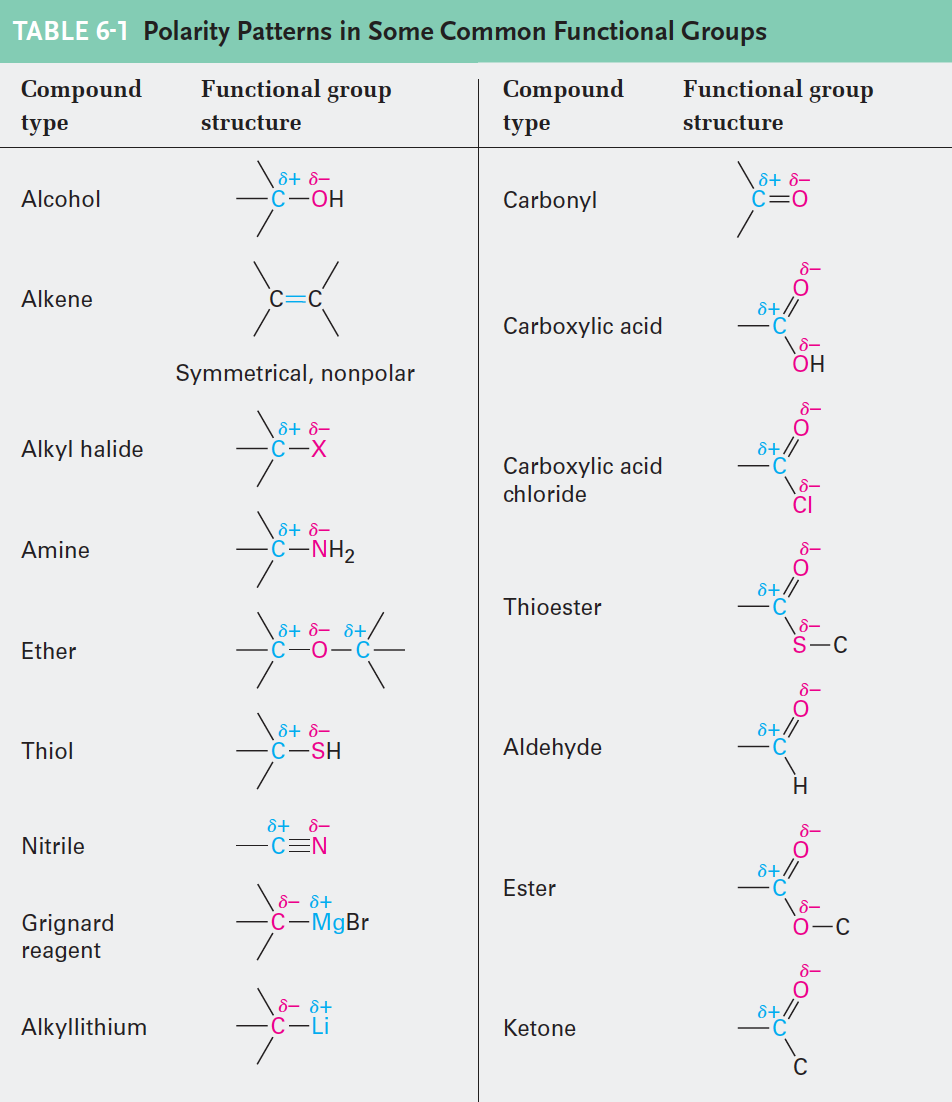
- 기본적으로 모든 극성 유기 반응에서 전자가 풍부한 자리와 전자가 부족한 자리가 서로 반응한다. 전자가 풍부한 원자가 부족한 원자에 전자 한 쌍을 주어 새로운 결합이 형성되고, 한 원자가 이전에 형성된 결합으로부터 두 개의 전자를 가지고 떨어지면 결합이 끊어진다.

- 친핵체(nucleophile): 음으로 편극되고, 전자-풍부한 원자를 가지고 있다. 전자-부족한 원자에 한 쌍의 전자를 주며 결합을 형성할 수 있다. (=Lewis base)
- ex. Ammonia, water, hydroxide ion
- 친전자체(electrophile): 양으로 편극되고, 전자-부족한 원자를 가지고 있다. 친핵체로부터 한 쌍의 전자를 받아 결합을 형성할 수 있다. (=Lewis acid)
- ex. acid, alkyl halides, carbonyl compounds
Problem 6-4. Which of the following species are likely to be nucleophiles and which electrophiles? Which might be both?

Answer.
(a) electrophile (electron-poor carbon)
(b) nucleophile (S의 lone-pair가 수소를 받아들이기 좋음)
(c) nucleophile (N의 lone-pair가 수소를 받아들이기 좋음)
(d) nucleophile/electrophile 두 가지로 작용 가능 (C=O bond의 C는 electron-poor, O는 electron-rich)
Problem 6-5. An electrostatic potential map of boron trifluoride is shown. Is BF3 likely to be a nucleophile or an electrophile? Draw a Lewis structure for BF3, and explain your answer.

Answer.
boron은 electrostatic potential map에서 전자-부족 상태이기 때문에 electrophile처럼 보인다. 하지만 lewis structure를 그렸을 때 아래와 같이 옥텟 규칙을 만족하지 않고 오비탈이 비어있기 때문에 친핵체로부터 전자를 받아들일 수 없다.

반응형